民进党“一苗两制” 联亚疫苗未通过EUA高端却轻松过关斩将

台湾自产联亚新冠肺炎疫苗申请紧急用户许可证(EUA)闯关失败。台当局卫福部门主管陈时中16日在疫情防控记者会表示,联亚疫苗未过关的原因在于“效力不足”,因此,被民进党当局一路护航的高端疫苗成为台湾唯一自产疫苗,将于23日开始施打,首波将供货61.4万剂予36岁以上民众注射。据了解,台当局领导人蔡英文预约23日接种,而曾经表示“手臂要留给联亚”的台当局副领导人赖清德也将登记施打高端疫苗。
据台湾《中国时报》报道,台卫福部门“食药署”在周日(15日)召开专家会议审查联亚疫苗EUA,在21名专家投票中,有17人不同意,另4人要求补件再议。
“食药署长”吴秀梅说,联亚疫苗未通过原因在于,中和抗体数据结果未达免疫桥接的不劣性标准,建议继续依原计划进行三期临床试验。陈时中则简单地说,“联亚未通过的原因就是效力不足”。
图片来源:台湾《中国时报》
联亚生技表示,对于无法取得EUA审核深感遗憾,然而“食药署”并未完整呈现联亚生技UB-612疫苗设计特性,实为民众重大损失,将提出申诉。
台卫福部门“疾管署”在5月28日与高端、联亚完成签约,每家采购500万剂疫苗,含开口合约最多各采购1000万剂。如今联亚EUA未过,本土疫苗是否出现空缺?陈时中却一再宣称,台当局采购的疫苗早已超越原先预定的数量,“目前疫苗数量足够,联亚若能进来,可能会早一点能有足量,但即使少了联亚,疫苗总量仍充足。”至于联亚已先生产的200多万剂疫苗,陈时中表示,会给予适当的材料费用补偿。
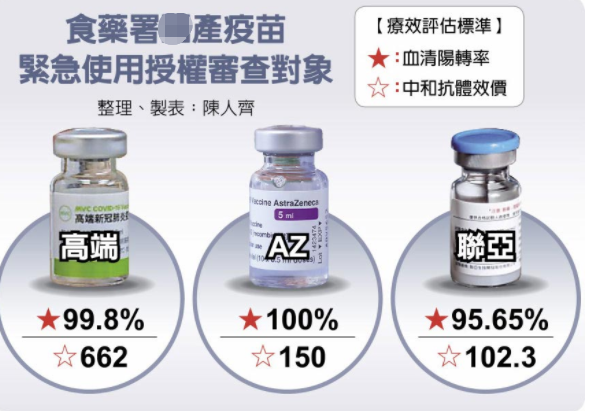
台专家:台当局疫苗效力评估标准没有科学依据
对于民进党当局所采用的疫苗效力评估标准,台“中研院”院士陈培哲表示,以比较中和抗体数据判断疫苗效力、作为是否通过紧急使用授权的标准没有科学依据,因这一数据并不能代表实际接种疫苗后产生的保护力。台湾本地疫苗取得紧急使用授权,必须以世界通用标准为主。
联亚疫苗临床试验总主持人、台湾中国医药大学附设医院感染管制中心副院长黄高彬表示,联亚的抗体效价较低不代表保护力较差,因为疫苗不能单看抗体效价数据,还要考虑T细胞反应的问题,不过既然台当局订出要用抗体效价来当审查标准,那也只能照这样的规则来走。这次审查联亚败在中和抗体效价这关,算是非战之罪,实际上联亚的中和抗体效价数字仍比高端漂亮的多,“但没过就没过,接下来就是继续精益求精,再求进步。”
至于是否比照高端疫苗公开专家审查会议纪录,陈时中表示,由于没通过EUA,因此没什么好公开的。对于联亚表示将至印度进行第三期临床试验,指挥中心发言人庄人祥说,联亚疫苗如经第三期临床试验证实具保护力,采购合约仍适用。
不过,曾为联亚受试者的前“卫生署长”杨志良认为,台当局应该公开两边相关审查资料,“让大家看看联亚还有哪些地方要跟高端学习?高端又是哪些地方优于联亚?大家一起互相学习。”也让联亚比较服气。
杨志良指出,台湾是高度政治对立的社会,既然现在都确定了,就应该把所有数据公开,他更担忧,接下来开始大量施打高端将会是一场政治豪赌,若赌赢,老百姓幸福,若赌输,现在Lambda病毒都出来了,到时候高端防护力不够,一旦没有防护力,将来施打高端的人可能都会染病成大破口。
3800名联亚受试者怎么办?

自产联亚疫苗没有通过紧急授权EUA,至于3800名受试者接下来该怎么办?台卫福部门主管陈时中曝2种选择。图片来源:台湾《中时电子报》
关于参加联亚第二期人体临床试验的3800多名受试者接下来该怎么办?陈时中表示,将依照受试者意愿,协助安排接种其他疫苗,可以打其他厂牌,也可以等联亚第三期临床试验。
指挥中心指出,参与联亚临床试验的受试者,签署受试者同意书时已充分告知,试验过程中可随时退出试验,且不需任何理由,临床试验受试者于退出或完成试验后之后续疫苗施打规划,将专案处理,接种前应与医师讨论身体状况,并经专业评估相关风险后再接种疫苗。
据了解,联亚疫苗第二期临床试验收案约3800人,包括12至18岁青少年、19至64岁的成人,以及65岁以上的长者。陈时中表示,若受试者想接种台湾现有的疫苗,会协助安排其他厂牌的疫苗接种,由于联亚仍可继续执行第三期人体临床试验,未来可循一般疫苗上市程序,向“食药署”申请药证,如果受试者要等到第三期临床试验,也尊重受试者意愿。【华夏经纬网综合报道】


